械领域的专业服务提供商,我们秉承为医疗厂家提供专业、高效、严谨的服务理念。在法规日趋严格的环境下,为产品进入欧美市场提供专业的法规支持。
2017年5月5日,新的欧盟MDR 2017/745和IVDR 2017/746法规发布,并正式在欧盟引入了UDI系统。
符合法规的医疗器械携带一个UDI,来自该器械的数据被提交到欧洲医疗器械数据库(EUDAMED)的UDI和器械注册模块。
UDI是通过全球接受的设备标识和编码标准创建的贸易商品的唯一标识符,形式为一系列数字或字母数字字符。它允许对市场上的特定设备进行明确的识别,并由DUI -DI和DUI - PI组成,它们一起在整个分发和使用过程中识别独特的医疗设备。
值得注意的是,MDCG指南规定,只要出现可能导致设备错误识别和/或其可追溯性不明确的变化,就需要新的UDI - DI。这与IE的标准和指南是一致的,但是,应该注意的是,在与EUDAMED 相关的各种文件中确定了其他UDI触发因素,例如UDI data dictionary.
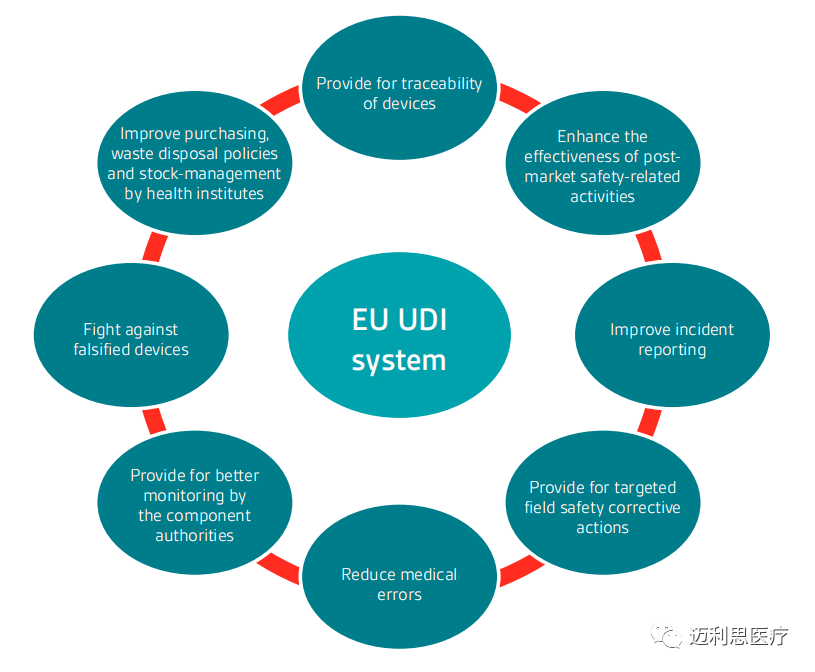
欧盟UDI系统的好处
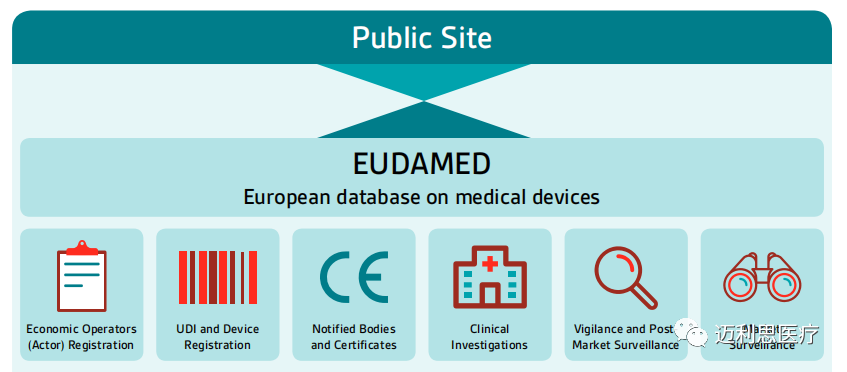
EUDAMED具有几大模块
关于遗留器械,是否需要输入EUDAMED
根据设备向法规的过渡时间,制造商可能需要在EUDAMED中提交遗留设备的UDI和设备注册信息。欧委会已发布指南,确定当发生严重事故或现场安全纠正措施适用于这些设备类型时,强制注册这些设备类型,要求它们尽快注册,至少在提交后续或最终警戒报告之前。遗留设备需要在申请之日起18个月内注册(或在MDR第34(3)条所述通知发布之日起24个月内注册,如果在MDR申请之日之前EUDAMED还没有完全发挥作用),除非在遗留设备发生严重事件或现场安全纠正措施之前,MDR或IVDR等价产品已经上市并在EUDAMED注册。
由于基本的UDI-DIs和UDI不应用于遗留设备,EC已经在EUDAMED中创建了一种机制来分配一个EUDAMED-DI(相当于基本的UDI-DI)和EUDAMED-DI(相当于UDI-DI)。这些赋值的目的是为在EUDAMED中注册的所有设备保持相同的标准结构和标识元素。如果已经分配了一个UDI-DI,制造商可以将该UDI-DI用于eudamide - id /UDI-DI。两者通过B前缀(用于EUDAMED-DI)和D前缀(用于UDI-DI)区分。如果设备在注册时还没有被制造商分配一个UDI-DI,系统将提供一个EUDAMED-DI并自动生成适当的EUDAMED-DI。
在任何一种情况下,随着制造商朝着符合法规的方向发展,EUDAMED有望提供将遗留设备连接到符合法规的设备的能力,只要符合法规的设备是相同的(除了它符合法规)。链接是在UDI-DI级别上建立的。如果UDI-DI是相同的,EUDAMED的这个链接可能是自动的;如果没有,制造商可以通过提供旧的设备标识符来手动创建链接。
为了提供更高效的服务,欢迎联系我们
联系人:
Jerry Zhou(周伟):176 2176 0832 (微信同号)


 沪ICP备20008359号-1
沪ICP备20008359号-1